Unidad de Investigación Clínica

Contamos con una Unidad de Investigación Clínica Especializada, perteneciente al RENIECYT, y reconocida internacionalmente, así como con profesionales de la salud con grados doctorales e inscritos en el Sistema Nacional de Investigadores, lo que nos ha permitido trabajar en conjunto con empresas alrededor del mundo para el desarrollo de tecnología para la generación de nuevos fármacos y dispositivos médicos. Lo anterior ha propiciado que CRMQ sea reconocido como pionero en el ámbito mundial en algunas modalidades terapéuticas de vanguardia, tales como:
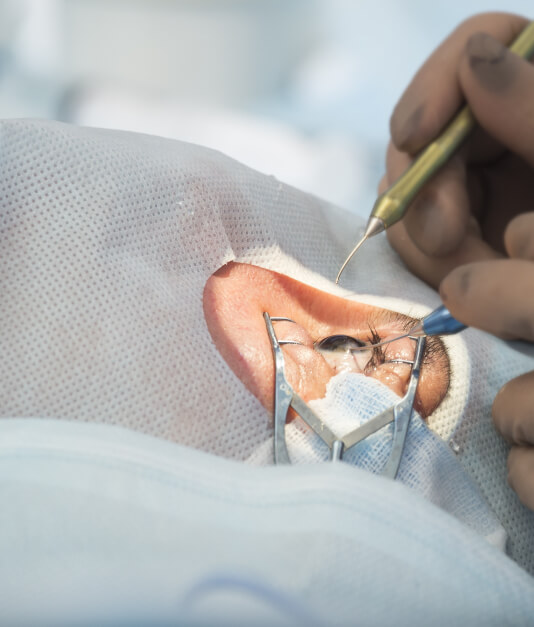
- ARGUS II, con la empresa Second Sight Inc. También conocido como “ojo biónico” o “implante de retina”, es el primer sistema de prótesis de retina con visión artificial aprobado para restaurar la visión en personas que sufren ceguera.
- Así mismo se desarrolló investigación clínica con Opko Health para la generación de un sistema basado en nanotecnología para la administración tópica de fármacos dirigidos al tratamiento de padecimientos que afectan a la retina (evitar inyecciones intraoculares)
- Desarrollo de tecnología de células encapsuladas para el tratamiento de la degeneración macular relacionada con la edad, en conjunto con la empresa estadunidense Neurotech Inc.
- Microbombas oftálmicas implantables, un sistema biomédico-micro-electro-mecánico (BIOMEM) para la liberación intraocular sostenida de fármacos con la empresa Replenish Inc.
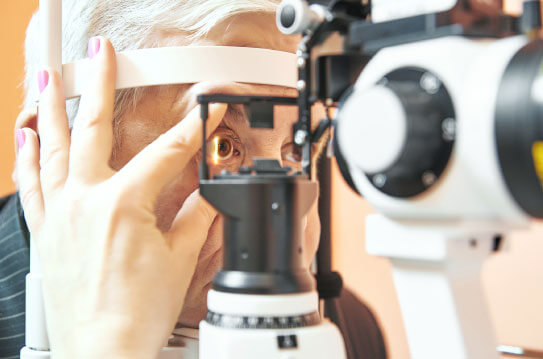
Nuestra unidad de investigación clínica está certificada en la ISO 9001:2015, comprendiendo los procesos de “Conducción de estudios de investigación clínica en oftalmología con base en los requerimientos de nuestros clientes y partes interesadas como unidad de investigación clínica.” que considera el contexto y las partes interesadas de la organización.
En Centro de Retina Médica y Quirúrgica, nos comprometemos a realizar estudios clínicos en oftalmología de manera ética, cumpliendo los estándares normativos, de calidad y de seguridad pertinentes aplicables a nuestros clientes y partes interesadas; buscando garantizar siempre su satisfacción.
Nuestro compromiso incluye el cumplimiento de todos los requisitos legales, éticos y reglamentarios relacionados con nuestras actividades de investigación clínica. Además, nos esforzamos por mejorar continuamente nuestro sistema de gestión de la calidad mediante la revisión periódica de nuestros procesos, la identificación de áreas de mejora y la implementación de acciones correctivas y preventivas.
Al adherirnos a esta política de calidad, buscamos promover la excelencia en la realización de estudios clínicos en oftalmología, contribuyendo al avance de la ciencia y al bienestar de nuestros pacientes y la comunidad en general.
1. Reclutamiento: Cumplir con al menos el 95% con el número de individuos participantes como sujetos voluntarios, en el tiempo acordado con nuestros clientes.
2. Apego al paciente: Mantener el porcentaje de asistencia de los pacientes, en los eventos que incluya el estudio clínico, mayor a 95%.
3. Desviaciones: No tener más de 5% de desviaciones al protocolo con base a los requerimientos establecidos por el cliente.
4. Tiempo de Reclutamiento de protocolo: Reducir el tiempo de reclutamiento del protocolo en un 5% al establecido por el cliente.
Servicios
- Asesoramiento para la generación de documentación necesaria para la aprobación de protocolos clínicos por parte de los comités de investigación y comités de ética en investigación
- Revisión de la documentación necesaria para la aprobación de protocolos clínicos por parte de los comités de investigación y comités de ética en investigación
- Sometimiento de protocolos ante comités de investigación y comités de ética en investigación
- Asesoramiento para la generación de documentación necesaria para la autorización de protocolos clínicos por la Comisión Federal para Protección contra Riesgos Sanitarios (COFEPRIS)
- Revisión de documentación necesaria para la autorización de protocolos clínicos por la Comisión Federal para Protección contra Riesgos Sanitarios (COFEPRIS)
- Sometimiento de protocolos ante la Comisión Federal para Protección contra Riesgos Sanitarios (COFEPRIS)
- Reclutamientos de sujetos de prueba, que cumplan con los criterios de inclusión y exclusión solicitados por cada protocolo.
- Realizamos las pruebas de diagnóstico requeridas para cada protocolo para la realización de pruebas preliminares.
- Recolección de consentimientos informados firmados por los sujetos de prueba.
- Contamos con una red de médicos referidores para cumplir con la cantidad de sujetos requeridos por cada protocolo.
- Evaluaciones preliminares propias de cada protocolo.
- Realización de pruebas de cada protocolo, como el suministro de fármacos, dispositivos médicos y/o evaluación de equipos médicos
- Apego al paciente para garantizar el cumplimiento de sus visitas a las pruebas requeridas por cada protocolo.
- Generación de documentación propia de cada protocolo.
- Relación con el monitor de la organización para la revisión periódica de avance de protocolo clínico.
- Generación de documentación necesaria para el cierre del sitio clínico.
- Asesoramiento para la notificación a la COFEPRIS sobre el cierre de sitio clínico.
- Sometimiento de cierre de sitio clínico a la COFEPRIS.
Almacenamiento de información
- Almacenamiento de la información propia de cada protocolo conforme a los lineamientos establecidos por la COFEPRIS o propias de cada organización.
Próximamente
· COMITÉ DE ÉTICA EN INVESTIGACIÓN
Para implementar protocolos clínicos de la rama de la oftalmología, póngase en contacto con nosotros, a través de correo electrónico o vía telefónica, agende una cita, conozca nuestras instalaciones y el equipo médico que puede llevar con éxito su protocolo clínico.
